Structura proteinelor și software-ul de proiectare primesc Nobelul pentru Chimie
Un academic și doi oameni de la DeepMind iau acasă Nobelul.

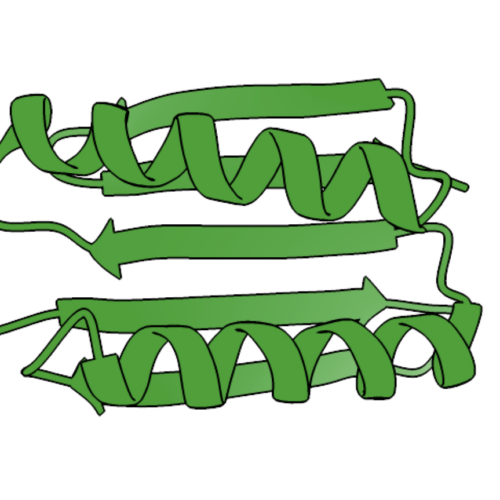
Prima proteină concepută de om care a adoptat o configurație specifică. Credit: Johan Jarnestad/Academia Regală Suedeză de Științe
Miercuri, Comitetul Nobel a anunțat că a acordat Premiul Nobel pentru chimie cercetătorilor care au făcut descoperiri majore în chimia computațională. Printre acestea se numără doi cercetători de la Google DeepMind, care recunosc rolul lor în dezvoltarea software-ului AI care ar putea prelua o secvență de proteine brute și să o folosească pentru a prezice structura tridimensională pe care proteina o va adopta în celule. Separat, David Baker de la Universitatea din Washington a fost onorat pentru dezvoltarea de software care ar putea proiecta proteine complet noi cu structuri specifice.
Premiul reprezintă o mică temă pentru anul acesta, ca premiul de fizică de ieri onorate evoluțiile AI. În acest caz, legătura cu fizica părea puțin slabă, dar aici, nu ar trebui să existe nicio îndoială că evoluțiile au rezolvat probleme majore în biochimie.
Înțelegerea structurii proteinelor
DeepMind, reprezentat de Demis Hassabis și John Jumper, a dezvoltat AI care au reușit să stăpânească jocuri la fel de diverse precum şah şi StarCraft. Dar a lucrat mereu la probleme mai semnificative în paralel și, în 2020, a surprins mulți oameni anunțând că a abordat una dintre cele mai mari provocări de calcul existente: predicția structurilor proteinelor.
Din punct de vedere chimic, proteinele sunt un șir liniar de aminoacizi legați între ele, creaturile vii având de obicei alegerea a 20 de aminoacizi diferiți pentru fiecare poziție de-a lungul șirului. Majoritatea celor 20 au proprietăți chimice distincte: unele sunt acide, altele bazice; unele pot fi încărcate negativ, altele încărcate pozitiv, iar altele neutre etc. Aceste proprietăți permit diferitelor zone ale șirului să interacționeze între ele, făcându-l să se plieze într-o structură tridimensională complexă. Această structură este esențială pentru funcția proteinei.
De obicei, descoperirea structurii implică o biochimie laborioasă pentru a purifica proteina, urmată de o serie de tehnici de imagistică pentru a determina unde se află fiecare dintre atomii săi. Dar, în teorie, toate acestea ar trebui să fie previzibile, deoarece structura este doar produsul chimiei și fizicii. Deoarece orice aminoacid ar putea interacționa cu oricare altul din lanț, totuși, complexitatea de a face predicții crește foarte rapid odată cu lungimea proteinei. Extindeți-l peste o duzină de aminoacizi și ar putea umili rapid cele mai puternice supercomputere.
De-a lungul anilor, s-a depus multă muncă în încercarea de a găsi comenzi rapide de calcul. DeepMind, în schimb, a făcut ceea ce a făcut cel mai bine și a pus o IA pe carcasă. Pentru plierea proteinelor, AI a fost antrenat pe două seturi mari de date existente. Unul a inclus fiecare structură de proteine care a fost rezolvată prin lucrări de laborator, permițându-i să extragă principii generale despre modul în care diferiți aminoacizi interacționează de obicei. A doua a fost secvența fiecărei proteine pe care le-am determinat, permițându-i să identifice proteinele legate de evoluție și să determine ce fel de flexibilitate poate fi tolerată într-o anumită structură.
Rezultatul net este un software care a produs predicții structurale rezonabile, depășind cu ușurință orice alt pachet software pe care l-am dezvoltat într-o provocare de calcul obișnuită. DeepMind l-a folosit de atunci pentru a genera predicții pentru majoritatea genelor care codifică proteine existente în bazele de date (încă se luptă cu cele excesiv de lungi) și a continuat să upgrade software-ul. Predicțiile nu sunt perfecte, iar unele par să se poticnească prost, dar când alternativa este pur și simplu un șir de aminoacizi și o ridicare din umeri, aceasta reprezintă un progres major.
Rolăm pe al nostru
Universitatea din Washington David Baker a încercat, de asemenea, să abordeze problema plierii proteinelor timp de câțiva ani, luând câteva abordări distincte. Software-ul Rosetta dezvoltat de grupul său a fost adaptat pentru a funcționa ca proiect de calcul distribuit (Rosetta@home) și a servit ulterior drept bază pentru un joc de pliere a proteinelor numit Foldit. Când DeepMind și-a anunțat software-ul AlphaFold, a făcut parte dintr-un grup care a adoptat rapid unele dintre principiile sale într-o versiune au numit RosettaFold.
Dar grupul său a abordat și o a doua întrebare: putem folosi capacitatea de a prezice structurile proteinelor pentru a face, în esență, invers, de a descoperi structura proteinelor naturale? Cu alte cuvinte, putem proiecta proteine care nu există în lumea naturală pentru a se plia în structuri specifice?
În ultimii câțiva ani, aceste întrebări au primit clar răspunsul cu un „da”. Uneori mi se pare că primesc e-mailuri lunare despre cele mai recente descoperiri apărute din laboratorul Baker, iar unele dintre ele par semnificative. De exemplu, laboratorul a dezvoltat sisteme care pot lua o proteină țintă și sugerează secvența de aminoacizi un anticorp care se va lipi de ele. Laboratorul a dezvoltat, de asemenea, software care poate lua o proteină cu o structură cunoscută și poate proiecta alte proteine care va interacționa cu ei și le va inhiba.
Acești inhibitori vizați au potențialul de a inhiba proteinele care sunt mutate în boli genetice sau de a oferi un răspuns rapid la agenții patogeni emergenti. S-ar putea să nu fie întotdeauna cea mai bună sau mai rapidă modalitate de a realiza aceste lucruri, dar cu cât avem mai multe opțiuni, cu atât mai bine. Și sunt doar un instantaneu restrâns al tuturor proiectelor care par să se desfășoare în laborator.
Având în vedere că știința este un efort de colaborare masiv și că Premiul Nobel se limitează la onorarea a trei persoane în fiecare an, vor exista întotdeauna discuții cu privire la faptul dacă unii contribuitori demni au fost excluși. Dar, în acest caz, este puțin probabil să existe multe discuții asupra faptului dacă realizările au fost demne de atenție.
John este editorul științific al Ars Technica. Are o licență în arte în biochimie de la Universitatea Columbia și un doctorat. în biologie moleculară și celulară de la Universitatea din California, Berkeley. Când este separat fizic de tastatură, el tinde să caute o bicicletă sau o locație pitorească pentru a comunica cu bocancii de drumeție.
-

1. Două instrumente nemaivăzute până acum, din același grup, infectează dispozitivele cu aer întrerupt
-
2. Fisker în faliment spune că nu își poate migra vehiculele electrice pe serverul unui nou proprietar
-
3. În sfârșit, mergem la cea mai intrigantă, dar neexplorata frontieră a Sistemului Solar
-
4. Rapoarte: China a piratat Verizon și AT&T, este posibil să fi accesat sistemele de interceptare telefonică din SUA
-
5. Producătorii de medicamente nu mai pot produce medicamente de slăbit imitative – și sunt supărați