Primul tratament din lume care utilizează CRISPR tehnologia de editare genetică a fost aprobată.
Exa-cel, cunoscut și sub numele său de marcă Casgevy, a primit primul său aprobare reglementară pe 16 noiembrie 2023 de la Agenția de Reglementare a Medicamentului și Produselor de Sănătate din Regatul Unit (MHRA) pentru a trata două tulburări de sânge debilitante: siclemie și beta-talasemie dependentă de transfuzii. Consilierii administrației americane pentru alimente și medicamente (FDA) au stabilit că medicamentul era sigur pentru uz clinic la sfârșitul lunii octombrie, iar FDA însăși este de așteptat să decidă dacă să aprobe tratamentul până în decembrie.
Decizia istorică a MHRA de a aproba Casgevy poate semnala începutul unei noi ere a terapia genică. Cu toate acestea, rămân întrebări legate de accesibilitatea tratamentului și siguranța pe termen lung.
Iată ce știm până acum despre Casgevy.
Legate de: Cancerul unei adolescente este în remisie după ce a primit celule noi editate cu CRISPR
Ce tratează prima terapie CRISPR aprobată?
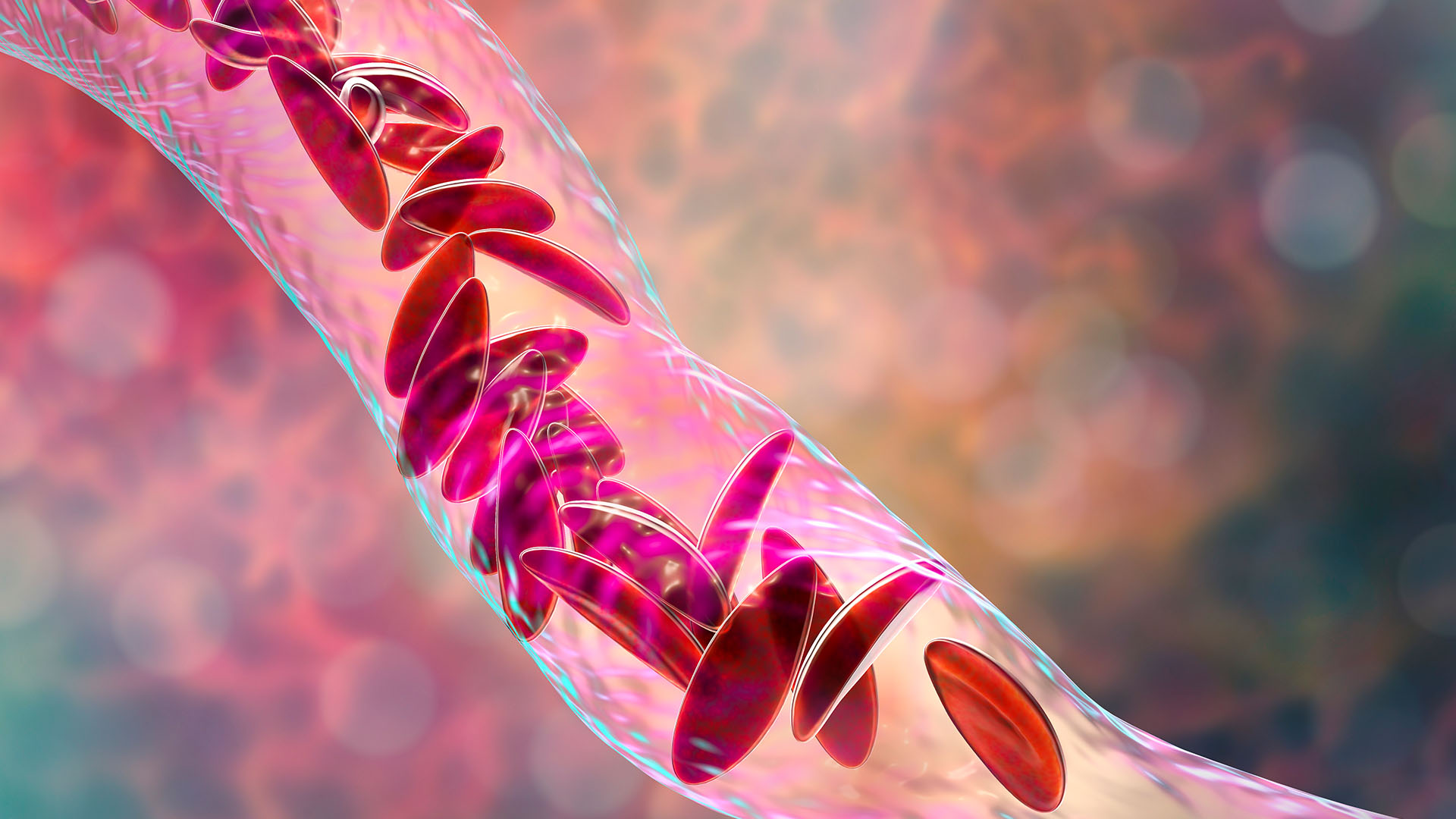
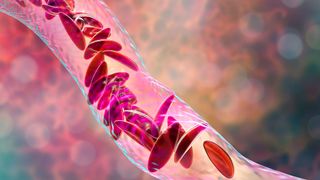
MHRA a aprobat Casgevy pentru a trata boala cu celule falciforme (SCD) și beta-talasemia dependentă de transfuzii. Acestea sunt tulburări genetice pe tot parcursul vieții, cauzate de mutații ale genelor care codifică hemoglobina, o proteină de care celulele roșii din sânge au nevoie pentru a transporta oxigenul în corp.
Peste 100.000 de oameni în SUA se estimează că au SCD, dar ratele sunt mai mari pentru unele populații decât pentru altele. De exemplu, 1 din 365 de copii de culoare se naște cu SCD. Boala schimbă forma globulelor roșii ale unei persoane, astfel încât acestea să devină în formă de C, mai degrabă decât rotunde. Celulele asemănătoare secera mor rapid și, de asemenea, se lipesc unele de altele, blocându-se vase de sânge. Ca urmare, pacienții se dezvoltă anemie și adesea experimentează accese de durere severă numite crize de durere.
beta-talasemia afectează în jur 1 din 100.000 de oameni la nivel mondial și îi afectează în mod disproporționat pe cei din Descendență mediteraneană, asiatică, africană și din Orientul Mijlociu. Pacienții cu beta-talasemie nu produc suficientă hemoglobină, ceea ce poate duce la anemie severă, în timp ce anemia falciformă provine din lipsa globulelor roșii sănătoase. „Dependent de transfuzii” înseamnă că boala este atât de gravă încât trebuie să aibă pacienții transfuzii regulate de globule roșii de-a lungul vieții lor.
Cum funcționează Casgevy?
Casgevy se bazează pe o tehnică revoluționară de editare a genelor numită CRISPR, care a fost dezvoltat pentru prima dată în 2012 .
Sistemul CRISPR elimină genele din ADN folosind o enzimă numită Cas9. Aceste „foarfece moleculare” sunt ghidate pentru a ținti ADN-ul printr-o moleculă de ARN. Tehnologia a fost adaptată dintr-un mecanism natural de apărare care bacterii și alte organisme simple numite arhaea folosesc împotriva virușilor.
Casgevy vizează o genă numită BCL11A. Gena codifică o proteină care ar regla în mod normal trece de la versiunea fetală a hemoglobinei la versiunea pentru adulți la scurt timp după naștere. Cu toate acestea, la pacienții cu SCD și beta-talasemie, hemoglobina adultului este defectă.
Scopul lui Casgevy este de a dezactiva BCL11A și astfel să permită organismului să continue să producă hemoglobină fetală, deoarece versiunea pentru adulți nu funcționează. Pentru a face acest lucru, celulele stem care produc sânge sunt prelevate din măduva osoasă a unui pacient, iar gena BCL11A este editată folosind Casgevy în laborator. Celulele nou modificate cu hemoglobina funcțională sunt apoi infuzate înapoi în corpul pacientului. Înainte de perfuzie, pacientul trebuie să ia un medicament pentru chimioterapie numit busulfan pentru a elimina celulele needitate încă din măduva osoasă, STAT News a raportat.
Acest proces de adaptare la noile celule editate este lung. „Pacienții ar putea avea nevoie să petreacă cel puțin o lună într-o unitate spitalicească, în timp ce celulele tratate își au reședința în măduva osoasă și încep să producă globule roșii cu forma stabilă de hemoglobină”, a spus MHRA într-un afirmație.
În două studii clinice în stadiu avansat, Casgevy a restabilit producția de hemoglobină la majoritatea pacienților cu SCD și beta-talasemie și le-a atenuat simptomele. Douăzeci și opt din 29 de pacienți cu SCD nu a experimentat nicio criză de durere severă timp de cel puțin un an după ce a fost tratat cu Casgevy. În mod similar, 39 din 42 de pacienți cu beta-talasemie nu a avut nevoie de transfuzii de globule roșii în aceeași perioadă post-tratament. Restul de trei pacienți au avut mai mult de 70% mai puține șanse de a avea nevoie de o transfuzie.
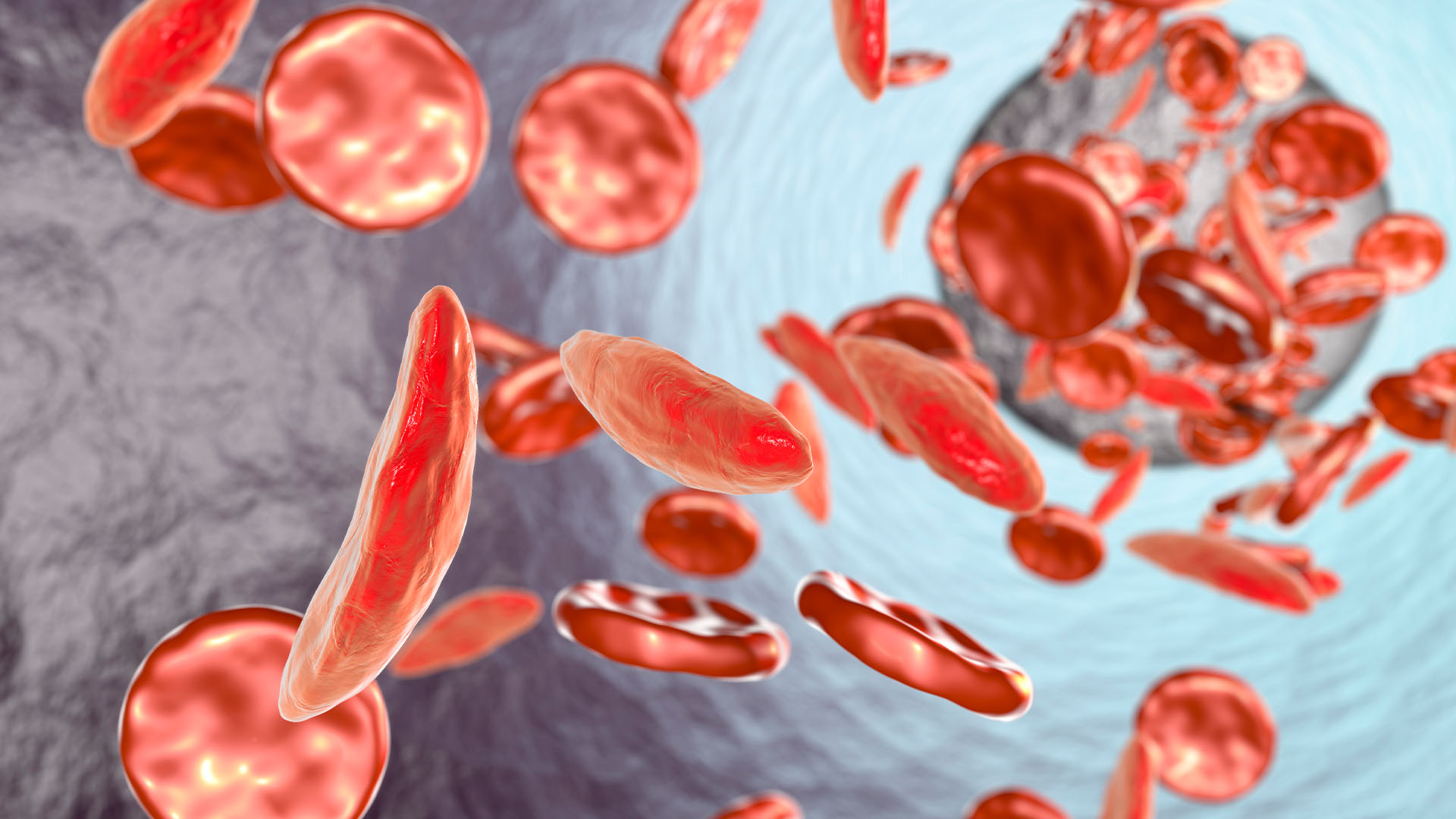
Este Casgevy în siguranță?
Nu au fost semnalate probleme serioase privind siguranța în niciunul dintre cele două studii clinice avansate ale lui Casgevy, deși au fost raportate unele efecte secundare tranzitorii, cum ar fi febra și oboseala. Ambele studii sunt în desfășurare, iar siguranța pe termen lung a lui Casgevy continuă să fie monitorizată de organismele de reglementare, cum ar fi MHRA și FDA, și de producătorii terapiei. Vertex Pharmaceuticals și CRISPR Therapeutics.
Cu toate acestea, există încă unele preocupări cu privire la siguranța terapiilor bazate pe CRISPR, în general. Și anume, există îngrijorări cu privire la efectele „în afara țintă”, care apar atunci când Cas9 acționează asupra altor părți ale genomului care nu au fost intenționați să fie modificate și să provoace efecte secundare nedorite.
„Este bine cunoscut faptul că CRISPR poate duce la modificări genetice false cu consecințe necunoscute asupra celulelor tratate.” David Ruedapreședintele de biofizică moleculară și celulară la Imperial College London, a declarat pentru Centrul media științific din Marea Britanie. „Ar fi esențial să vedem datele de secvențiere a întregului genom pentru aceste celule înainte de a ajunge la o concluzie”, a spus el. Aceasta ar implica examinarea întregului ADN din celulele editate de Casgevy pentru a vedea dacă există efecte în afara țintei.
Legate de: Două femei câștigă Premiul Nobel pentru Chimie pentru instrumentul de editare genetică CRISPR
Unde a fost aprobat Casgevy?
De la mijlocul lunii noiembrie, doar Marea Britanie a aprobat Casgevy. MHRA a aprobat tratamentul pentru oameni peste 12 ani.
Dar conform Vertex, tratamentul este în prezent revizuit de Agenția Europeană pentru Medicamente a Uniunii Europene, Autoritatea Saudită pentru Alimente și Medicamente și FDA. Se așteaptă ca FDA să aprobe Casgevy la sau înainte de 8 decembrie, a raportat STAT News.

Când va fi Casgevy disponibil pacienților?
Nu este clar când va deveni disponibil Casgevy, dar acoperirea sa va depinde în mare măsură de costul său. Terapiile genice pot costa milioane de dolari și se pare că Casgevy nu va face excepție. Acest lucru l-ar putea face inaccesibil pentru mulți oameni care au nevoie de el.
„Provocarea este că aceste terapii vor fi foarte scumpe, așa că o modalitate de a le face mai accesibile la nivel global este cheia.” Kay Daviesun profesor de anatomie la Universitatea din Oxford, a declarat pentru Science Media Centre din Marea Britanie.
Vertex încă nu a stabilit un preț pentru Casgevy în Marea Britanie, un purtător de cuvânt al companiei a spus Naturedar „colaborează cu autoritățile sanitare pentru a asigura rambursarea și accesul pacienților eligibili cât mai repede posibil”.
Ce alte terapii CRISPR sunt în dezvoltare?
Intellia Therapeutics dezvoltă terapii CRISPR pentru a trata bolile moștenite din interiorul corpului, a raportat STAT News.
În plus, o versiune ajustată a CRISPR numită „editare de bază”, care poate viza elementele de bază individuale ale ADN este testat ca o modalitate de a trata boala. De exemplu, Verve Therapeutics testează un astfel de tratament experimental pentru boli de inima. Un alt nou tip promițător de terapie, numită „editare primară”, implică CRISPR, dar, de asemenea, „incorporează enzime suplimentare și instrucțiuni genetice pentru a introduce, șterge sau rescrie segmente scurte de ADN”, a raportat STAT News.
Acest articol are doar scop informativ și nu este menit să ofere sfaturi medicale.
Te-ai întrebat vreodată de ce unii oameni își construiesc mușchi mai ușor decât alții sau de ce ies pistruii la soare? Trimite-ne întrebările tale despre cum funcționează corpul uman community@livescience.com cu subiectul „Health Desk Q” și este posibil să vedeți răspunsul la întrebarea dvs. pe site!