Aurich Lawson
În 1972, Janet Rowley s-a așezat la masa din sufragerie și a tăiat cromozomi minusculi din fotografiile pe care le făcuse în laboratorul ei. Rând pe rând, ea a tăiat figurile mici pe care copiii ei le numeau tachinat păpuși de hârtie. Apoi le-a așezat cu grijă în 23 de perechi potrivite – și și-a avertizat copiii să nu strănute.
Doctorul-om de știință tocmai însușise o nouă tehnică de colorare a cromozomilor într-un an sabatic la Oxford. Dar în sala de mese a casei ei din Chicago a făcut descoperirea care avea să modifice dramatic cursul cercetării cancerului.
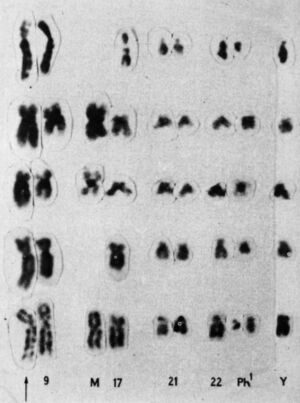
Mărește / Cariotipul parțial al lui Rowley din 1973 care arată translocarea 9;22
Privind peste cromozomii unui pacient cu leucemie mieloidă acută (AML), ea și-a dat seama că segmente de cromozomii 8 și 21 s-au rupt și au schimbat locurile— un comerț genetic numit translocare. S-a uitat la cromozomii altor pacienți cu LMA și a văzut aceeași schimbare: translocarea 8;21.
Mai târziu în același an, ea a văzut o altă translocare, de data aceasta la pacienți cu un alt tip de cancer de sânge, numit leucemie mielogenă cronică (LMC). Se știa că pacienții cu LMC prezintă o anomalie surprinzătoare în cromozomul 22, care l-a făcut să pară mai scurt decât în mod normal. Anormalitatea a fost numită cromozomul Philadelphia după descoperirea lui de către doi cercetători din Philadelphia în 1959. Dar abia când Rowley a examinat cu atenție masa ei de sufragerie așezată meticulos, a devenit clar de ce cromozomul 22 era mai scurt – o bucată din el se rupsese și schimbase locuri cu o mică secțiune a cromozomului 9, o translocare 9;22.
Rowley a avut primele dovezi că anomaliile genetice sunt cauza cancerului. Ea și-a publicat descoperirile în 1973, cu translocarea CML publicată în un studiu cu un singur autor în Nature. În anii care au urmat, ea a susținut cu fermitate ideea că anomaliile sunt semnificative pentru cancer. Dar inițial a fost întâmpinată cu scepticism. La acea vreme, mulți cercetători considerau anomaliile cromozomiale ca fiind un rezultat al cancerului, nu invers. Descoperirile lui Rowley au fost respinse din prestigiosul New England Journal of Medicine. „Am primit o toleranță amuzată la început”, a spus ea înainte de moartea ei în 2013.
Nașterea tratamentelor țintite
Dar dovezile au crescut rapid. În 1977, Rowley și doi dintre colegii ei de la Universitatea din Chicago au identificat o altă translocare cromozomială –15;17— care provoacă un cancer al sângelui rar numit leucemie promielocitară acută. Până în 1990, peste 70 de translocații au fost identificate în cancere.
Semnificația a crescut și ea rapid. După descoperirea lui Rowley a translocației 9;22 în LMC, cercetătorii au descoperit că schimbul genetic creează o fuziune a două gene. O parte a genei ABL care se găsește în mod normal pe cromozomul 9 devine atașată de gena BCR de pe cromozomul 22, creând gena de fuziune BCR::ABL care conduce la cancer pe cromozomul 22. Această fuziune genetică codifică o proteină de semnalizare – o tirozin kinază – adică blocat permanent în modul „activ”. Ca atare, declanșează permanent căi de semnalizare care conduc celulele albe din sânge să crească necontrolat.
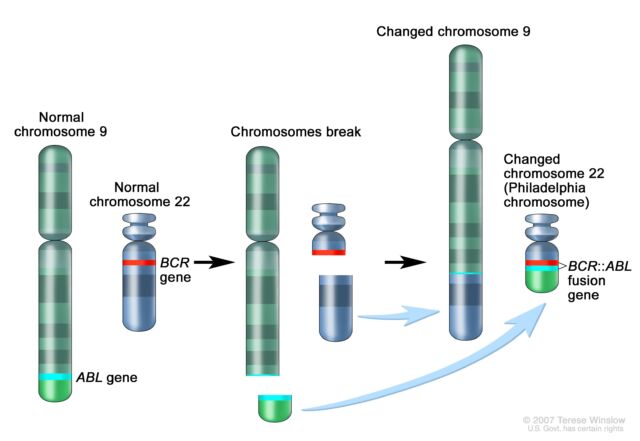
Mărește / Schema translocației 9;22 și a creării genei de fuziune BCR::ABL.
La mijlocul anilor 1990, cercetătorii au dezvoltat un medicament care blochează proteina BCR-ABL, un inhibitor al tirozin kinazei (TKI) numit imatinib. Pentru pacienții în faza cronică de LMC – aproximativ 90 la sută dintre pacienții cu LMC – imatinib a crescut rata de supraviețuire la 10 ani de la mai puțin de 50 la sută la putin peste 80 la suta. Imatinib (vândut ca Gleevec sau Glivec) a obținut aprobarea de la Food and Drug Administration în 2001, marcând prima aprobare pentru o terapie împotriva cancerului care vizează o alterare genetică cunoscută.
Odată cu succesul imatinibului, terapiile țintite împotriva cancerului – alias medicina de precizie – au luat amploare. La începutul anilor 2000, a existat un interes larg răspândit în rândul cercetătorilor de a identifica cu precizie bazele genetice ale cancerului. În același timp, dezvoltarea revoluționară a secvențierii genetice de următoarea generație a acționat ca combustibilul de reacție pentru câmpul în creștere. Tehnologia a ușurat identificarea mutațiilor și a anomaliilor genetice care provoacă cancer. Secvențierea este acum considerată îngrijire standard în diagnosticul, tratamentul și managementul multor tipuri de cancer.
Dezvoltarea terapiilor de cancer care vizează gene a crescut vertiginos. Clasele de TKI, cum ar fi imatinib, s-au extins deosebit de rapid. Există acum peste 50 de TKI aprobate de FDA care vizează o mare varietate de cancere. De exemplu, TKI-urile lapatinib, neratinib, tucatinib și pirotinib țintă receptorul 2 al factorului de creștere epidermic uman (HER2), care funcționează în unele cazuri de cancer mamar și gastric. Ruxolitinib TKI vizează Janus kinaza 2, care este adesea mutată în cancerul de sânge rar mielofibroza si cancer de sânge cu creștere lentă policitemie vera. Pacienții cu LMC, între timp, au acum cinci terapii TKI din care să aleagă.