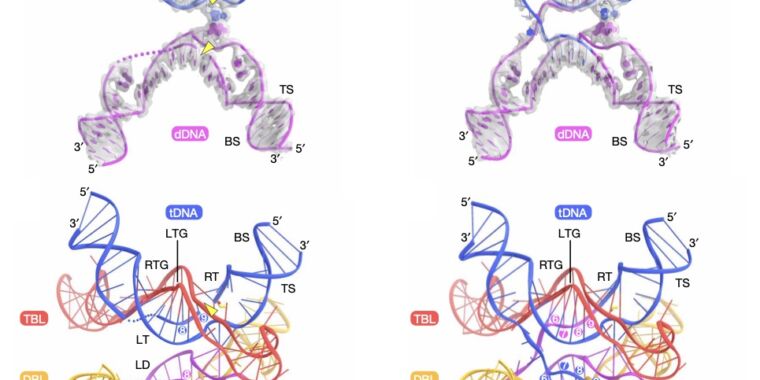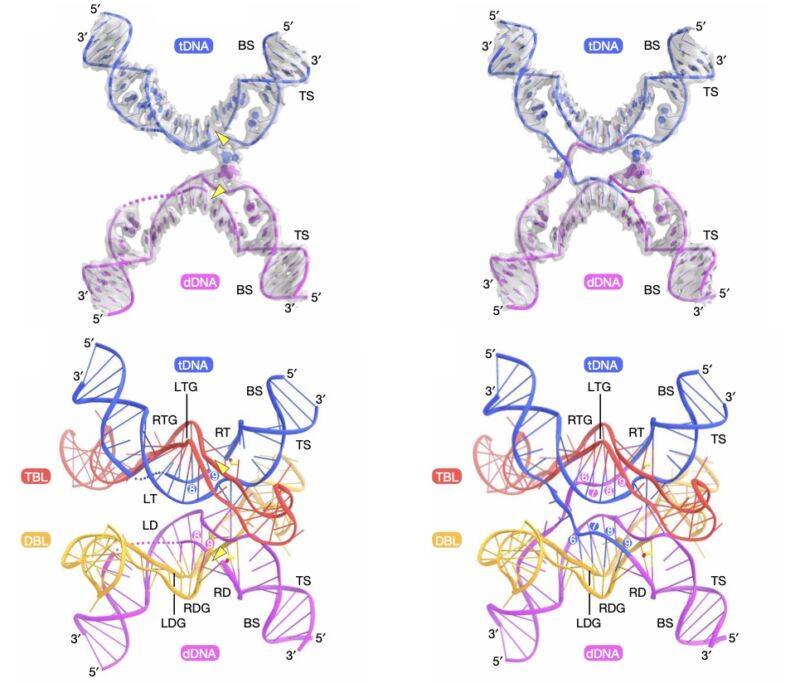
Mărește / Rândul de sus: pași individuali în procesul de reacție. Rândul de jos: diagramă de desene animate din partea de sus, care arată poziția fiecărei catene de ADN și ARN.
Hiraizumi, et. al.
În timp ce CRISPR este probabil cea mai proeminentă tehnologie de editare a genelor, există altele, unele dezvoltate înainte și după. Și oamenii au dezvoltat variante CRISPR pentru a îndeplini funcții mai specializate, cum ar fi modificarea bazelor specifice. În toate aceste cazuri, cercetătorii încearcă să echilibreze o serie de factori concurenți: comoditate, flexibilitate, specificitate și precizie pentru editare, rate scăzute de eroare și așa mai departe.
Deci, a avea opțiuni suplimentare pentru editare poate fi un lucru bun, permițând noi modalități de echilibrare a acestor nevoi diferite. Miercuri, o pereche de lucrări în Nature descriu un parazit bazat pe ADN care se mișcă în jurul genomului bacterian printr-un mecanism care nu a fost descris anterior. Nu este nici pe departe gata de utilizare la oameni, dar poate avea unele caracteristici distinctive care îl fac să merite o dezvoltare ulterioară.
Devenind mobil
Elementele genetice mobile, numite în mod obișnuit transpozoni, sunt destul de comune la multe specii – ele alcătuiesc aproape jumătate din secvențele din genomul uman, de exemplu. Ele sunt într-adevăr mobili, apărând în noi locații de-a lungul genomului, uneori prin decuparea și săritul în noi locații, alteori prin trimiterea unei copii într-un loc nou din genom. Pentru ca toate acestea să funcționeze, ei trebuie să aibă o enzimă care să taie ADN-ul și să recunoască în mod specific secvența de transpozon potrivită pentru a fi introdusă în tăietură.
Specificul acestei interacțiuni, necesar pentru a se asigura că sistemul inserează doar copii noi ale lui însuși, și tăierea ADN-ului, sunt caracteristici pe care le-am dori pentru editarea genelor, ceea ce acordă o mai bună înțelegere a acestor sisteme.
Genomul bacterian tind să aibă foarte puțini transpozoni – ADN-ul suplimentar nu este în concordanță cu abordarea reproducerii bacteriene de „copie tot ADN-ul cât mai repede posibil atunci când există hrană în jur”. Cu toate acestea, transpozonii bacterieni există, iar o echipă de oameni de știință din SUA și Japonia a identificat unul cu o caracteristică destul de neobișnuită. Ca pas intermediar în deplasarea într-o nouă locație, cele două capete ale transpozonului (numit IS110) sunt legate între ele pentru a forma o bucată circulară de ADN.
În forma sa circulară, secvențele de ADN de la joncțiune acționează ca un semnal care îi spune celulei să facă o copie ARN a ADN-ului din apropiere (numit „promotor”). Când este liniar, fiecăruia dintre cei doi biți de ADN de pe ambele părți ale joncțiunii nu are capacitatea de a acționa ca un semnal; funcționează doar când transposonul este circular. Iar cercetătorii au confirmat că există de fapt un ARN produs de forma circulară, deși ARN-ul nu codifică nicio proteină.
Deci, echipa de cercetare s-a uitat la peste 100 de rude diferite ale IS110 și a descoperit că toți ar putea produce ARN-uri similare care nu codifică proteine, toate având unele caracteristici cheie. Acestea au inclus întinderi în care secțiunile din apropiere ale ARN-ului s-ar putea perechi de baze între ele, lăsând o buclă nepereche de ARN între ele. Două dintre aceste bucle conțineau secvențe care fie s-au împerecheat cu bazele cu transpozonul însuși, fie la locurile din E coli genomul unde s-a introdus.
Aceasta sugerează că ARN-ul produs de forma circulară a transpozonului a ajutat să acționeze ca un ghid, asigurându-se că ADN-ul transpozonului a fost utilizat în mod specific și inserat doar în locații precise din genom.
Editare fără precizie
Pentru a confirma acest lucru este corect, cercetătorii au dezvoltat un sistem în care transposonul ar produce o proteină fluorescentă atunci când a fost introdus corect în genom. Ei au folosit acest lucru pentru a arăta că mutațiile din bucla care a recunoscut transpozonul l-ar împiedica să fie inserat în genom – și că era posibil să-l direcționeze către noi locații din genom prin schimbarea secvențelor de recunoaștere din a doua buclă.
Pentru a arăta că acest lucru a fost potențial util pentru editarea genelor, cercetătorii au blocat producția de ARN propriu al transpozonului și i-au alimentat cu un ARN de înlocuire care a funcționat. Deci, puteți utiliza acest sistem pentru a introduce secvențe ADN arbitrare în locații arbitrare dintr-un genom. Ar putea fi folosit și cu ARN-uri de țintire care au determinat ștergerea unor secvențe specifice de ADN. Toate acestea sunt potențial foarte utile pentru editarea genelor.
Accent pe „potențial”. Problema este că secvențele de direcționare din bucle sunt destul de scurte, cu site-ul de inserție vizat de o secvență de recunoaștere care are doar patru până la șapte baze. La capătul scurt al acestui interval, te-ai aștepta ca un șir aleatoriu de baze să aibă un loc de inserție aproximativ o dată la 250 de baze.
Această specificitate relativ scăzută a arătat. La nivel superior, diferite experimente ar putea observa o precizie de inserare variind de la 94% aproape de a fi util până la 50% amenințător pozitiv. Pentru experimentele de ștergere, limita de jos a intervalului a fost o precizie catastrofală de 32%. Deci, deși acesta are unele caracteristici ale unui sistem interesant de editare genetică, este mult de lucru înainte ca acesta să poată îndeplini acest potențial. Este posibil ca aceste bucle de recunoaștere să fie mai lungi pentru a adăuga tipul de specificitate care ar fi necesar pentru editarea genomurilor de vertebrate, dar pur și simplu nu știm în acest moment.