
Oamenii de știință au introdus CRISPR în lume ca instrument de editare genetică în vara anului 2012, când lucrările de referință ale două grupuri independente au demonstrat cum ar putea fi folosit sistemul pentru a face tăieturi în ADN. Acum, la mai puțin de 12 ani mai târziu, vedem CRISPR folosit în tratamente medicale inovatoare.
Virginijus Šikšnys a fost un autor principal al una dintre acele lucrări de schimbare de paradigmă.
„Este cu adevărat satisfăcător să vezi cât de repede sunt transpuse în clinici descoperirile fundamentale care au fost făcute în laborator”, a spus Šikšnys, om de știință șef și șef al Departamentului de Interacțiuni proteine-ADN de la Institutul de Biotehnologie al Universității din Vilnius. Lituania.
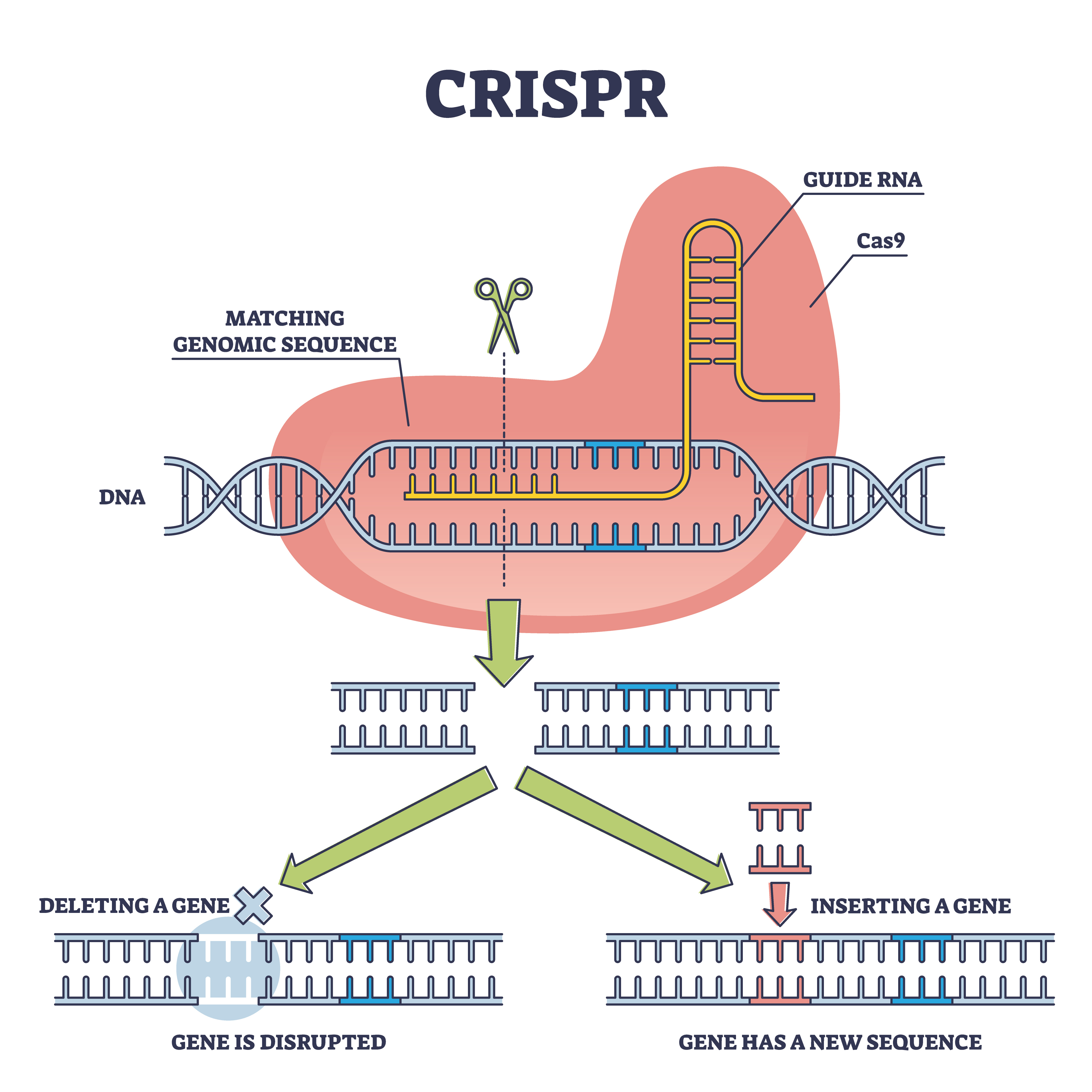
Înainte de aceste lucrări fundamentale, alți cercetători au început să dezvăluie cum funcționează CRISPR în interiorul microbilor. Deși cel mai bine cunoscut ca instrument de editare genetică, CRISPR a fost găsit pentru prima dată în bacteriiiar oamenii de știință și-au dat seama că acționează ca un fel de sistem imunitar – o apărare împotriva virusuri. În acest sistem imunitar, bacteria are o bancă de memorie plină de material genetic al virusului. Bacteria va ascunde acest material după ce a fost atacată de un virus, astfel încât să se poată proteja împotriva invaziilor viitoare.
Această bancă de memorie este asociată cu foarfece mici, moleculare, numite proteine Cas, care trec prin ADN și o moleculă care ghidează foarfecele către ținta lor. În bacterii, acea țintă este un invadator viral. Dar Šikšnys și colegii săi au demonstrat că oamenii de știință ar putea coopta aceste foarfece pentru propriile lor scopuri, țintind orice ADN pe care doresc să-l editeze. Ei au arătat acest lucru în mod specific cu proteina Cas9.
pe langa Jennifer Doudna și Emmanuelle Charpentier — autori de cealaltă hârtie revoluționară CRISPR publicat în 2012 — Šikšnys a fost distins cu Premiul Kavli 2018 pentru Nanoștiință pentru inventarea lui CRISPR-Cas9, „un nanoinstrument precis pentru editarea ADN-ului”. În prezent, el și echipa sa investighează diversitatea sistemelor CRISPR care există în natură pentru a vedea care altele ar putea fi utile pentru inginerie genomului.
Live Science a vorbit cu Šikšnys despre cum a fost să vezi CRISPR intrând în utilizare clinică și despre cum crede el că sistemul ar putea fi aplicat și îmbunătățit în viitor.
Nota editorului: Acest interviu a fost condensat și editat pentru claritate.
Legate de: Terapia genică: ce este și cum funcționează?

Nicoletta Lanese: Ai putea să descrii când ai început să lucrezi cu CRISPR-Cas? Și ați putea să dați o idee despre momentul în care v-ați implicat în ideea că aceasta ar putea fi „o mare problemă” – o tehnologie de mare împuternicire care schimbă editarea genetică așa cum o știm noi?
Virginijus Šikšnys: Am sărit în domeniul CRISPR, aș spune, de la bun început. S-a întâmplat probabil în 2007 când a apărut o lucrare în Science, descriind pentru prima dată posibila funcție a sistemului CRISPR-Cas ca sistem de apărare antiviral în bacterii. Și am decis să ne uităm, de fapt, la modul în care funcționa acest sistem. Așa am început călătoria noastră CRISPR.
Desigur, la început, ne-au interesat foarte mult întrebările biologice de bază. … Ne-a luat ceva timp să înțelegem mecanismele din spatele sistemelor CRISPR-Cas. …
În [our 2012] hârtie, am arătat că putem reprograma proteina Cas9 și o putem adresa oricărei secvențe din genom. Acesta a fost probabil momentul în care am înțeles că, într-adevăr, acesta este un fel de sistem cu adevărat versatil care ar putea fi folosit pentru editarea genomului în diferite organisme model. Și așa a început, atunci, acest tip de domeniu de editare genetică.
NL: V-ați imaginat imediat că acest lucru ar putea fi aplicat în tratamentul tulburărilor genetice? Ai văzut asta ca o posibilitate, chiar de la început?
VS: Dacă îmi amintesc, ceea ce am pus în lucrarea noastră la acel moment – am spus că aceste sisteme CRISPR-Cas, sau proteina Cas9 programată de CRISPR ARNar putea fi folosit pentru “chirurgie ADN” precisă.
Înseamnă că, de fapt, puteți direcționa Cas9 către orice secvență din genom, inclusiv secvențele în care [there are] mutații care cauzează boli genetice.
NL: După ce am văzut, în ultimul an, primele terapii bazate pe CRISPR ieșite pe piață, mă întreb cum se simte când am văzut progresul domeniului de la acea cercetare de bază la a-l vedea acum aplicat la acel nivel?
VS: Într-adevăr, privind înapoi, este cu adevărat uimitor să vezi că Cas9 a ajuns în clinici, aproape în 10 ani. Cred că este o realizare foarte mare și sunt sigur că vor urma mai multe aplicații terapeutice în viitorul apropiat și vor oferi leac[s] pentru boli genetice care înainte erau incurabile.
Și dacă te uiți la lista de studii clinice care sunt în desfășurare în prezent, în cazul în care instrumentul de editare a genomului Cas9 este folosit pentru a trata diferite boli genetice – lista este într-adevăr foarte impresionantă. Și este cu adevărat satisfăcător să vezi cât de repede sunt transpuse în clinici descoperirile fundamentale care au fost făcute în laborator.
NL: După ce am văzut absolvirea în clinică acum, cum anticipați că sistemele de editare genetică realizate de CRISPR-Cas ar putea fi perfecționate în viitor?
VS: Într-adevăr, tehnologia CRISPR-Cas9 este un instrument excelent care avansează rapid în clinici. Dar totuși, există mai multe provocări care trebuie depășite și există, desigur, căi de îmbunătățire a acestui instrument. …
Recent, a făcut titluri despre acel instrument CRISPR a fost utilizat pentru tratamentul bolii MSC [sickle-cell disease]. De fapt, [it] a arătat că acesta este într-adevăr un instrument care ar putea fi folosit în clinici pentru tratamentul pacienților.
Dar, desigur, acest tratament are mai multe limitări, deoarece, în acest caz, tratamentul are loc ex vivo. Înseamnă că celulele care trebuie tratate sunt îndepărtate din corpul pacientului, apoi instrumentul Cas9 este aplicat pentru a corecta mutația – sau de fapt, declanșează producția de hemoglobină fetală. Și apoi aceste celule proiectate, ele trebuie să fie livrate înapoi în corpul pacientului. Și, desigur, aceasta este un fel de procedură provocatoare și consumatoare de timp.
Deci, desigur, ar fi grozav dacă tratamentul CRISPR s-ar putea face direct în [the] corpul uman – îl numim in vivo. Dar, de fapt, pentru a face asta, trebuie să depășiți mai multe provocări: în primul rând, trebuie să livrați acest instrument CRISPR în anumite țesuturi sau organe din corpul uman. Și, desigur, există multe modalități de a furniza instrumente CRISPR, dar după COVID, Vaccinurile ARNm au fost aprobate ca modalitate terapeutică de tratament [prevention] de COVID. Și în prezent, ARNm cuplat cu nanoparticule lipidice a devenit una dintre modalitățile cheie care ar putea livra Cas9 în diferite celule și țesuturi dintr-un corp uman.
[Other] sistemele de livrare sunt de asemenea [being] explorate, inclusiv particule asemănătoare virusurilor și virușii adeno-asociați. Deci, AAV-urile sunt, de asemenea, folosite ca instrumente de livrare și sunt aprobate ca instrumente de livrare sigure în corpul uman – dar, de exemplu, în cazul AAV, există o limitare a încărcăturii și trebuie să găsiți instrumente mai mici de editare a genelor care ar putea fi ambalate. într-o singură particulă AAV.
În laboratorul meu, de fapt, ne uităm la căi – cum îmbunătățiți instrumentele existente sau, de fapt, găsiți instrumente noi? Pentru a găsi noi instrumente, ne uităm la diversitatea sistemelor CRISPR-Cas. Aceste sisteme CRISPR-Cas [in nature] sunt foarte, foarte diverse și ne propunem să înțelegem această diversitate a sistemelor CRISPR-Cas dintr-o perspectivă fundamentală. Și, de asemenea, sperăm că, privind această diversitate, vom putea găsi noi instrumente pentru aplicațiile de editare a genomului.
Legate de: Faceți cunoștință cu „Fanzor”, primul sistem asemănător CRISPR găsit în viața complexă
NL: Ați putea face o imagine a cum arată să cercetați diversitatea acestor sisteme?
VS: În laboratorul meu, folosim o abordare biochimică combinată bazată pe bioinformatică. Așa că încercăm să identificăm noi sisteme CRISPR-Cas presupuse din punct de vedere bioinformatic și apoi, încercăm să le caracterizăm biochimic folosind instrumentele disponibile în laboratorul umed. …
În primul rând, ne uităm la [microbial DNA] secvențe care sunt prezente în baze de date foarte uriașe — puteți încerca doar să găsiți noi sisteme CRISPR acolo. Apoi, încercăm să le exprimăm în diferite bacterii, să le izolăm, să le caracterizăm și apoi să le mutăm în celulele umane pentru a vedea dacă pot fi aplicate ca noi instrumente de modificare a genomului.
NL: Ne-am referit la tratamentele cu celule falciforme care tocmai au fost aprobate — mă întreb dacă dumneavoastră, ca și alții, ați anticipat că drepanocitul va fi una dintre primele boli care vor primi un tratament CRISPR? Și ce boli vedeți ca fiind următoarea frontieră?
VS: Aș spune că a fost clar de la bun început că bolile genetice care sunt cauzate de o singură mutație, cum ar fi siclemia, vor fi prima țintă. Arăta ca un fruct care agăța jos, pentru că trebuie să corectezi doar o singură mutație a genomului. Și, desigur, cred că o parte din meritul pentru acest tratament bazat pe Cas9 al drepaniei ar trebui să se îndrepte și către oamenii care au studiat boala secerică timp de decenii. Ne-au oferit înțelegerea mecanismelor bolii care au fost valorificate în tratament.
Celălalt motiv pentru care SCD a fost o țintă clară a fost pentru că, așa cum am menționat anterior, puteți face tratamentul [ex] vivo. Puteți elimina celulele care conțin [the] mutație, de fapt, proiectați-le în laborator și puneți celulele înapoi în corpul uman. Deci asta ușurează manipulările.
Dar, desigur, când te gândești la următorul pas – tratamentul bolilor genetice care sunt cauzate de mutații multiple, cum ar fi cancerul, de exemplu, este încă o provocare. Dar, desigur, oamenii de știință încearcă să dezvolte abordări pentru a aborda o astfel de boală genetică complexă. Și, de exemplu, terapiile pe bază de celule T sunt deja în clinici și CRISPR [systems] sunt folosite acolo pentru a facilita inginerie dintre aceste celule T… care ar putea fi folosite pentru a trata cancere precum limfoamele și tumorile solide.
Și, desigur, tratamentele CRISPR în corpul uman, așa cum am discutat înainte, este următorul mare pas.
Frumusețea tehnologiei CRISPR-Cas9 este că este un fel de tehnologie versatilă sau universală, deoarece puteți folosi acest instrument pentru a proiecta orice organism viu.
Virginijus Šikšnys, Universitatea din Vilnius
NL: Acest lucru este oarecum tangențial, dar am acoperit ideea dezvoltarea CRISPR ca antibacterianca un fel de antibiotic alternativ – îl vedeți ca un domeniu de cercetare fructuos?
VS: Frumusețea tehnologiei CRISPR-Cas9 este că este un fel de tehnologie versatilă sau universală, deoarece puteți folosi acest instrument pentru a proiecta orice organism viu. Încercați doar să creați ADN-ul, iar ADN-ul este modelul fiecărui organism viu. Deci, în loc să faceți editarea genelor în celulele umane, vă puteți gândi și la editarea populației bacteriene – să spunem, care sunt prezente în [the] intestin uman. Și aceste populații bacteriene ar putea fi modificate. …
Și, după cum ați menționat, tehnologiile Cas9, CRISPR ar putea fi folosite și ca agenți antivirali. În prezent, cel problema cu antibioticele este destul de clară — probabil că ne pierdem lupta împotriva bacteriilor folosind antibiotice. Antibioticele noi sunt întotdeauna necesare roșu și este cu adevărat dificil să le găsești, și provocatoare și costisitoare. Prin urmare, tehnologii alternative precum terapii virale sau sunt dezvoltate sisteme antibacteriene CRISPR.
NL: Evident, CRISPR are atât de mult potențial, mai ales în domeniul tratării bolilor genetice – cred că oamenii au și o mulțime de întrebări despre etica aplicării CRISPR în diferite contexte. Ai putea vorbi despre asta?
VS: Cred că este o întrebare foarte importantă și, desigur, CRISPR este o tehnologie foarte importantă și poți folosi CRISPR pentru a face multe lucruri. Dar, desigur, ar trebui să ții cont de ceea ce faci și trebuie să fii în contact și în conversație cu societatea — Sunt aceste lucruri acceptabile? Sau, care sunt opiniile societății cu privire la aceste tehnologii pe care oamenii de știință le dezvoltă în laborator? Și cred că este foarte important să comunicăm cu oamenii și să explicăm, de fapt, ce sunt aceste tehnologii, ce pot realiza și apoi care pot fi, de asemenea, dezavantajele acestor tehnologii.
Am auzit deja despre aceste povești că CRISPR a fost folosit cu câțiva ani în urmă în China pentru ingineria embrionilor umani — deci este o linie pe care oamenii de știință sunt de fapt de acord să nu o depășească, pentru că acesta ar putea fi un lucru cu adevărat periculos.
Te-ai întrebat vreodată de ce unii oameni își construiesc mușchi mai ușor decât alții sau de ce ies pistruii la soare? Trimite-ne întrebările tale despre cum funcționează corpul uman community@livescience.com cu subiectul „Health Desk Q” și este posibil să vedeți răspunsul la întrebarea dvs. pe site!