Într-o premieră istorică, Food and Drug Administration (FDA) a aprobat primul din America terapii genetice pentru boala cu celule falciforme (SCD), dintre care unul folosește instrumentul de editare genetică CRISPR.
„Drepanocitoarea este o afecțiune a sângelui rară, debilitantă și care pune viața în pericol, cu nevoi semnificative nesatisfăcute [for better, long-lasting treatments]și suntem încântați să facem progrese în domeniu, în special pentru persoanele ale căror vieți au fost grav perturbate de boală, aprobând astăzi două terapii genetice bazate pe celule”, Dr. Nicole Verdundirector al Biroului de Produse Terapeutice din cadrul Centrului pentru Evaluare și Cercetare Biologică al FDA, a declarat într-un declarație făcută vineri (8 dec.).
„Terapia genetică deține promisiunea de a oferi tratamente mai direcționate și mai eficiente, în special pentru persoanele cu boli rare, unde opțiunile de tratament actuale sunt limitate”, a spus ea.
Marea Britanie a devenit prima țară care a aprobat terapia bazată pe CRISPR, numit Casgevy, la mijlocul lunii noiembrie. Experții au anticipat că FDA va face ecou în curând decizia luată de autoritățile de reglementare din Marea Britanie, deoarece consilierii FDA au considerat tratamentul sigur pentru uz clinic încă din octombrie.
Legate de: Prima terapie CRISPR din lume tocmai a fost aprobată. Iată tot ce trebuie să știi
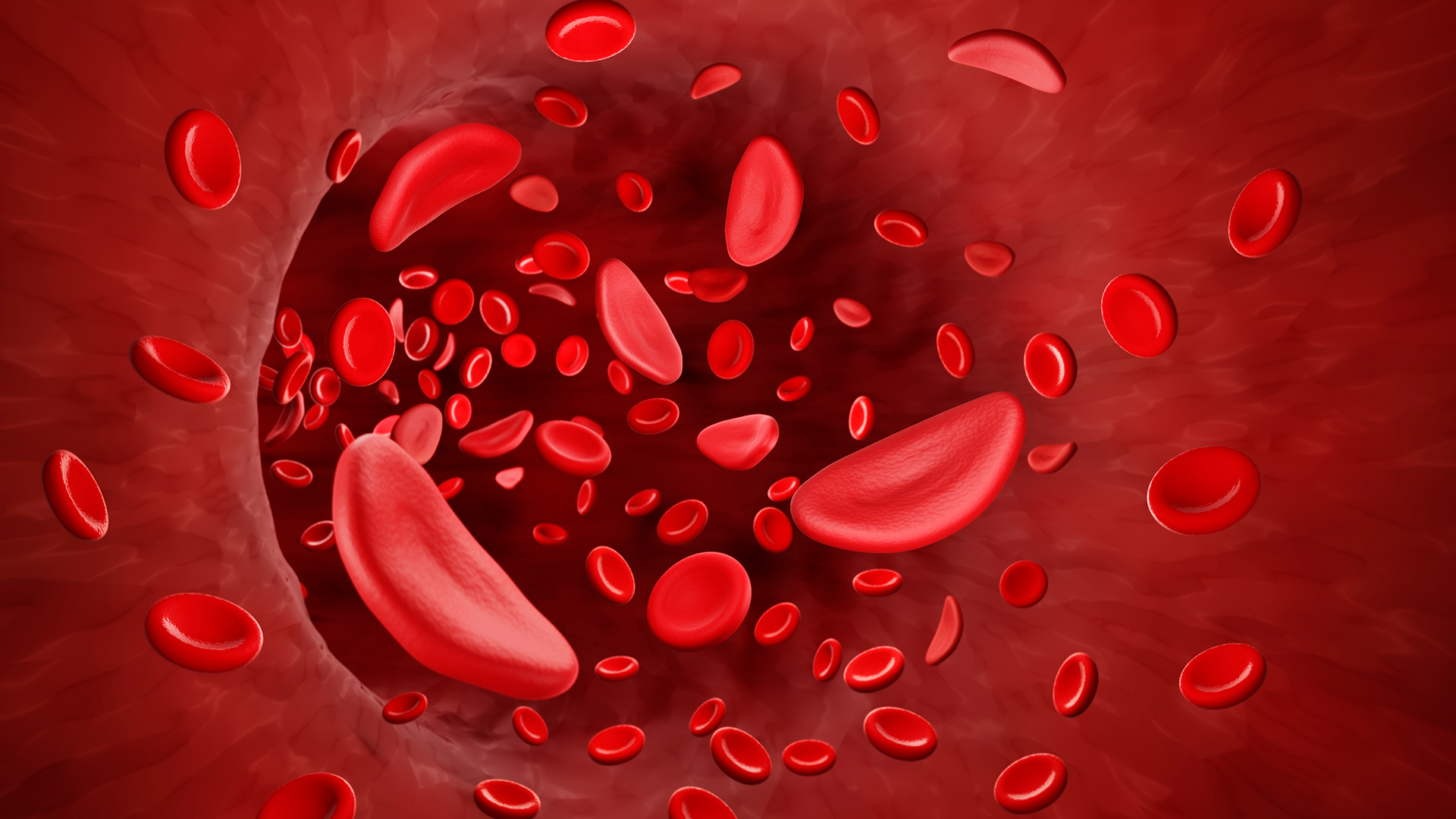
SCD este cauzate de mutații genetice care schimbă forma proteinei hemoglobinei, care transportă oxigenul în celulele roșii din sânge. Celulele roșii din sânge devin apoi în formă de seceră, mai degrabă decât rotunde, ceea ce le face să moară rapid și, de asemenea, să se lipească împreună, blocând vasele de sânge.
Terapia bazată pe CRISPR, Casgevy, oprește formarea celulelor prin oprirea unei gene numite BCL11A.
Sistemul CRISPR poate ghida cu precizie o pereche de foarfece moleculare către genele pe care medicii doresc să le dezactiveze și apoi să taie acea genă din ADN-ul unei persoane. Dezactivarea genei BCL11A face ca celulele pacientului să poată produce o versiune de hemoglobină produsă în mod normal numai în uter. Doar versiunea pentru adulți a hemoglobinei este afectată în SCD, astfel încât permiterea corpului să producă această hemoglobină fetală inversează anemiei pacientului.
„La pacienții cu siclemie, niveluri crescute de HbF [fetal hemoglobin] previne formarea celulelor roșii din sânge”, a declarat FDA.
Pentru a aplica tratamentul, medicii desenează mai întâi celulele stem din sânge ale pacientului – celule nespecializate care se pot transforma în diferite celule din sânge. Apoi, ei editează celulele pentru a dezactiva gena BCL11A și a le întoarce în corpul pacientului. Înainte de perfuzie, pacientul trebuie să ia un medicament pentru chimioterapie pentru a elimina celulele stem needitate încă din măduva osoasă.
A doua terapie genică aprobată de FDA, numită Lyfgenia, nu utilizează CRISPR. În schimb, tratamentul folosește un virus inofensiv, numit vector lentiviral, pentru a furniza ADN nou în celulele stem sanguine ale pacienților.
Virusul introduce o genă funcțională a hemoglobinei pentru a o înlocui pe cea mutantă a pacienților. Gena funcțională produce o versiune a hemoglobinei care este foarte asemănătoare cu cea observată la adulții fără SCD, dar are proprietăți suplimentare care ajută la limitarea secemiei celulelor sanguine. Celulele sanguine își schimbă forma în SCD atunci când hemoglobina anormală se adună, sau „polimerizează”, pentru a forma lanțuri rigide în interiorul celulelor. Hemoglobina ajustată folosită în Lyfgenia este mai rezistent la acea polimerizare decât hemoglobina normală, datorită structurii sale.
Ca și în cazul lui Casgevy, pacienții iau un medicament pentru chimioterapie înainte de a primi noile lor celule tratate cu Lyfgenia.
Casgevy este aprobat pentru pacienții cu SCD cu vârsta de 12 ani și peste, cu „crize vaso-ocluzive recurente”, adică evenimente în care celulele roșii secerate blochează fluxul de oxigen în organe, provocând leziuni tisulare și dureri severe. Lyfgenia este aprobat pentru pacienții cu vârsta de 12 ani și peste cu antecedente de evenimente vaso-ocluzive, categoria mai largă de complicații în care se încadrează crizele.
„Acțiunile de astăzi urmează evaluări riguroase ale datelor științifice și clinice necesare pentru a susține aprobarea, reflectând angajamentul FDA de a facilita dezvoltarea de tratamente sigure și eficiente pentru afecțiuni cu impact grav asupra sănătății umane”. Dr. Peter Marksdirector al Centrului de Evaluare și Cercetare a Produselor Biologice al FDA, a declarat în declarația FDA.
Te-ai întrebat vreodată de ce unii oameni își construiesc mușchi mai ușor decât alții sau de ce ies pistruii la soare? Trimite-ne întrebările tale despre cum funcționează corpul uman community@livescience.com cu subiectul „Health Desk Q” și este posibil să vedeți răspunsul la întrebarea dvs. pe site!